Операция при инсульте — показания и виды оперативного вмешательства, послеоперационный период, осложнения
Такая распространенная патология, как инсульт, является самой частой причиной смертности ‒ от этого заболевания каждые шесть секунд в мире умирает один человек. Несколько десятилетий назад инсульт диагностировался в большинстве случаев у пожилых людей, перешагнувших возраст 60–65 лет, но в последние годы болезнь значительно «помолодела» ‒ встречается даже у детей. Существует несколько методов борьбы с недугом, самый кардинальный из них ‒ операция.
Острое внезапное нарушение кровообращения мозга, приводящее к повреждению нервных клеток, называется инсультом. Патология характеризуется формированием локальной или общемозговой симптоматики неврологической природы, которая продолжается более суток или приводит к летальному исходу вследствие цереброваскулярных отклонений. Расположение поражения определяется с помощью МРТ (магнитно-резонансной томографии).
Существует так называемое «терапевтическое окно», которое составляет 3–6 часов после удара ‒ в течение этого времени можно предотвратить необратимые нарушения и гибель клеток с помощью лечебных манипуляций. Инсульт может иметь геморрагическую или ишемическую природу. В первом случае происходит кровоизлияние в головной мозг или его оболочки, во втором ‒ закупорка или сужение кровеносных сосудов головного мозга. Кроме того, существует спинальный инсульт, характеризующийся поражением спинного мозга.
Ишемический тип поражает чаще людей преклонного возраста (статистически вероятнее – мужчин), характеризуется постепенным нарастанием симптомов. Вследствие спазма сосудов происходит прекращение кровоснабжения мозга, что приводит к кислородному голоданию и отмиранию клеток. Существует мнение, что ишемический инсульт способны спровоцировать такие факторы, как стрессовое напряжение, повышенная физическая нагрузка или употребление алкоголя.
Геморрагический тип характеризуется кровоизлиянием в мозг, при этом гибель нервных клеток происходит вследствие сдавливания их гематомой. Основной причиной является истончение сосудистых стенок из-за церебральной патологии. В этом случае симптомы развиваются значительно быстрее, сопровождаются серьезными неврологическими отклонениями разной степени выраженности.
В 5% случаев развития заболевания не удается выяснить точный механизм возникновения поражения мозга. Лечение после инсульта заключается в восстановлении нервных клеток (нейронов), купировании воздействия первичных факторов, предупреждении повторного удара. Знание основных признаков патологии может спасти чью-то жизнь, поскольку срок оказания необходимой помощи при инсульте составляет 3–6 часов.
Инсульт относится к патологиям, которые требуют оказания незамедлительной медицинской помощи в течение нескольких часов во избежание развития необратимых процессов. Существуют разные методы борьбы с кровотечением, но часто самой действенной является операция после инсульта головного мозга, позволяющая полностью удалить очаг кровоизлияния. Показания к проведению хирургического вмешательства:
- Поражение (отек или сдавление) продолговатого мозга с образованием прогрессирующего неврологического дефекта ‒ так называемого мозжечкового инсульта (с очагом более 3 см).
- Гематома на коре полушарий, достигающая глубины не более 1 см при объеме освободившейся крови не более 30 мл.
- Аномалии сосудов разной природы (например, мальфорация или аневризма), сопровождающиеся кровотечением. Для подтверждения диагноза требуется проведение ангиографии.
- Коматозное состояние, продолжительность которого составляет более 6 часов. В этом случае эффективна декомпрессия с помощью удаления части черепа.
- Абсцессы и отеки головного мозга, травмы черепной коробки, аномалии развития черепа могут вызвать инсульт.
Любое оперативное вмешательство на открытом мозге всегда является большим риском и зачастую заканчивается развитием серьезных осложнений, в некоторых случаях – гибелью пациента. Хирургическая операция проводится только после установки точного диагноза, дифференциации ишемического или геморрагического типа от других неврологических патологий (например, аневризмы мозговых сосудов).
В последние годы появилось несколько малоизученных методик по удалению гематом, требующих наличия специального оборудования и обученного медицинского персонала. К таким операциям относят стереотаксический метод, при котором в черепе делается небольшой прокол, и эндоскопический, заключающийся в проделывании небольшого отверстия. Следует помнить, что все операции на мозге сопряжены с большим риском.
В большинстве случаев ишемический инсульт возникает на фоне гипертонической болезни, церебрального атеросклероза, пороков сердца. Характеризуется патология нарушением мозгового кровообращения, что ведет к недостаточному поступлению кислорода в ткани мозга, и, как следствие, разрушению нервных клеток. Закупорка артерий при этом происходит из-за оторвавшихся кусочков атеросклеротических бляшек, тромбов.
Терапия при ишемическом инсульте направлена на восстановление кровообращения в церебральных сосудах. Для этого применяются антиагреганты, тромболитики, антикоагулянты. В случаях, когда консервативное лечение неэффективно, проводится хирургическая операция:
- Каротидная эндартерэктомия подразумевает удаление внутренней стенки сонной артерии, которая поражена атеросклеротической бляшкой. Проводится под местной анестезией, подразумевает короткий период реабилитации и вызывает меньше осложнений, поскольку общий наркоз после инсульта может спровоцировать ухудшение общего состояния.
- Каротидное стентирование назначается пациентам, перенесшим в прошлом эндартерэктомию или тем больным, которым она противопоказана. Проводится при сужении диаметра просвета сонной артерии до 60%.
- Стентирование сонных артерий и удаление тромбов проводится без разрезов. Операция производится эндоваскулярным методом, в ходе ее в суженное место артерии вводится стент, который помогает обеспечить хороший кровоток.
- Селективный тромболизис – введение специальных препаратов, растворяющих тромбы.
При возникновении ОНМК (острого нарушения мозгового кровообращения) геморрагического типа проводятся несколько видов хирургических операций, но результативность каждой напрямую зависит от размера и локализации гематомы. Кроме того, некоторые из новейших методов недостаточно исследованы. Несколько эффективных видов хирургического вмешательства:
- Трепанация черепа по классической методике заключается в проделывании отверстия в черепной коробке, установке дренажа. Применяется при остром отеке мозга, снижает летальность от инсульта на 30%. Недостатком метода является высокая травматичность, поскольку трепанация черепа при инсульте всегда сопряжена с риском.
- Введение катетера в полость гематомы (стреотаксический метод) с целью удаления содержимого посредством аспирации. Проводится в случае глубокого кровотечения, иногда ‒ с добавлением тромболитиков. Недостатком является невозможность полностью остановить кровотечение.
- Удаление части кости черепа и закрытие места кожным лоскутом применяется при угрозе комы. При улучшении состояния пациента необходима повторная операция.
- Клипирование аневризмы заключается в наложении на шейку аневризмы специальной клипсы, которая остается внутри черепной коробки и предупреждает рецидив заболевания.
Операция на головном мозге ‒ всегда риск для жизни пациента, поэтому подходить к вопросу следует ответственно. При оказании своевременной качественной медицинской помощи и при отсутствии деструктивных изменений летальный исход возможен в 25–35% случаев. Существуют следующие противопоказания для проведения хирургического вмешательства:
- артериальная гипертензия;
- сердечная недостаточность;
- короткий промежуток между инсультом и инфарктом (менее полугода);
- сопутствующие патологии головного мозга регрессионного характера;
- возраст больного превышает 70 лет (не всегда является поводом для отказа);
- соматические заболевания (сахарный диабет, плохая свертываемость крови, печеночная и почечная недостаточность);
- злокачественные опухоли мозгового вещества;
- неврологический дефицит;
- нестабильная стенокардия;
- психические заболевания;
- острое воспаление с образованием гноя;
- коматозное состояние.
источник
Как показывает практический опыт, 1/5 часть из общего количества пациентов при таком диагнозе нуждается в хирургическом лечении. Практически 50% из числа всех существующих вмешательств на позвоночнике выполняются именно по поводу удаления межпозвонковых грыж. Например, в США ежегодно оперируют 200-300 тыс. человек, у которых диагностирована неблагополучная клиническая картина в структурах позвоночных дисков.
Но даже при успешно проведенных манипуляциях, у части пациентов (примерно у 25%) остается или через какое-то время рецидивирует корешковый синдром, сохраняются или возникают неврологические и двигательные расстройства. Клиническое обследование больных, которые попали в группу людей с неудовлетворительными результатами, установило, что причинами синдрома неудачно прооперированного позвоночника по большей мере являются:
- рецидивы грыжеообразования на том же уровне (8%);
- сужение позвоночного канала из-за экзостозов и артроза межпозвоночных суставов (4,5%);
- появление грыжи на смежном с прооперированным сегментом диске (3,5%);
- образование патологических рубцов и спаек в позвоночном канале (3%);
- рубцово-спаечных образований в нервных корешках (3%)
- постоперационные псевдоменингоцеле и спинально-эпидуральные гематомы (1%).
Зоны, куда может отдаваться болевой синдром.
Как можно проследить, особенную тревогу вызывают рецидивы заболевания в том же месте, где производилась резекция грыжевой ткани. И довольно часто – это следствие допущенных ошибок и неточностей в ходе реабилитационного периода, игнорирование в отдаленные сроки требований и ограничений, касающихся повседневного образа жизни. Кто после качественной реабилитации продолжил восстановление в санатории, меньше остальных рискуют столкнуться с последствиями. Поэтому этот факт нужно принять к сведению всем пациентам, поскольку закрепление достигнутых функциональных результатов сразу по окончании основной реабилитационной программы играет далеко не второстепенную роль.
По поводу осложнений на форум часто приходят письма, где пациенты винят в их появлении нейрохирургов, которые плохо сделали операцию. Непосредственно хирургия в разы реже становится виновницей неблагополучного прогноза. Современные нейрохирургические технологии сегодня великолепно продуманы от создания безопасного доступа до ультраточной визуализации, они отлично изучены, освоены и отточены до мелочей спинальными хирургами.
Отечественные клиники не имеют отлаженной системой реабилитации. Поэтому во многих наших больницах, соотношение последствий оперативного вмешательства и неграмотного послеоперационного восстановления примерно равное – 50/50. Люди, прооперированные, к примеру, в России, на жизнь после операции жалуются слишком часто, ее качество не всегда такое, о котором мечтали пациенты. Эффективность операций в целом по России – 80%.
От врача зависит 99% успеха лечения.
Поэтому лучше проходить операцию, чтобы гарантировано не стать жертвой неквалифицированных действий горе-хирурга, в ведущих зарубежных странах по хирургии позвоночника и опорно-двигательного аппарата (в Чехии, Германии, Израиле). Даже самые сложные в техническом плане манипуляции здесь вам проведут «чисто», безукоризненность ответственной процедуры обеспечена на 98%-100%.
Очень значимо и реабилитационное пособие получить качественно и в полном объеме, а вот эту часть лечебного процесса могут предоставить уже далеко не все зарубежные страны-лидеры. Нигде, кроме Чехии, программа операции по удалению грыжи позвоночника не учитывает нормальный курс реабилитационной терапии. Кроме того, стоимость полноценной чешской программы высокопрофессионального комплексного лечения в 2-3 раза ниже, чем цена в Германии и Израиле только на одну услугу врача-хирурга. Прогнозы на благополучный послеоперационный исход в Чехии – 95%-100%.
Мы не будем перечислять все пункты инструкции, она вам известна, поскольку всегда выдается на руки при выписке из стационара. Но вот о некоторых неосвещенных в выданной инструкции требованиях, о чем чаще всего на форумах спрашивают пациенты, считаем нужным осведомить. Итак, два самых распространенных вопроса: разрешена ли баня после операции и когда можно заниматься сексом?
- Где-то можно вычитать, что баня – это самое то против спаечно-рубцового процесса после удаления позвоночной грыжи. Внимание! Этот факт не имеет клинических подтверждений. Более того, в баню ходить запрещено после операции минимум 6 месяцев, а еще лучше год. Температурные процедуры, это стимуляторы метаболизма и нормализации функций организма и если имеется хотя бы малый признак внутреннего или наружного воспаления в зоне операционного поля, они же могут так же интенсивно и простимулировать прогрессирование воспалительной реакции. Парная способна вызвать отек операционной раны, расхождение «свежих» швов. А это – благоприятная среда для попадания патогенных бактерий и развития гнойно-инфекционного патогенеза.
- Что касается секса, его следует ненадолго исключить. Обычно врачи не советуют возобновлять половую активность как минимум 14 дней со дня вмешательства. И даже с этого момента, пока вы окончательно не восстановитесь, сексуальный контакт должен быть максимально безопасным. Вы должны быть пассивным партнером. Чтобы не причинить травму прооперированной части хребта, секс допускается щадящего типа, не отличающийся высоким напряжением. Правило отсутствия избыточной нагрузки на позвоночник, в частности на пояснично-крестцовый отдел (чаще грыжи удаляют именно в этом сегменте), должно соблюдаться примерно 6 месяцев.
Важно! Чтобы добиться полноценного восстановления качества жизни и избежать последствий, соблюдайте в строгости все противопоказания и показания, которые изложены в памятке, выданной вам при выписке из хирургического стационара. И непременно продолжите восстановление в реабилитационном центре. Стандартный срок обязательной реабилитации при условии положительной динамики составляет 3 месяца.
В первую очередь любое оперативное вмешательство, выполняемое при грыже позвоночника, преследует декомпрессию нервных структур, чтобы избавить пациента от неврологического дефицита и мучительной боли в спине и конечностях. Если чувствительность не возобновилась, а боли не устранены, можно говорить либо об остаточных симптомах, либо о последствиях. Болевой синдром в районе раны в ранний период наблюдается практически у всех, как нормальная реакция организма на операционную травму. Когда шов хорошо заживет, что обычно происходит в течение 3-7 дней, локальные болезненные признаки ликвидируются.
Постоперационным осложнением считается рецидив грыжи, встречаемость – 11,5% случаев из 100%. Произойти он может как в прооперированном сегменте (8%), так и на совершенно других сегментарных уровнях (3,5%). Полных гарантий, что грыжевое выпячивание не возникнет в ближнем или отдаленном будущем, вам не даст ни один оперирующий хирург, даже самый успешный. Однако можно максимально обезопасить себя от очередного формирования злополучного процесса в дисках позвоночника. И от пациента здесь очень многое зависит!
Вы должны четко понимать, что полноценная медреабилитация после процедуры удаления существенно сокращает вероятность повторного возвращения патологии, в связи с чем не должны отступать ни на шаг от предложенной реабилитологом и хирургом индивидуальной программы послеоперационного лечения. По максимуму предупредить данное последствие помогают интенсивные физические методы – ЛФК, физиотерапия, строго дозированный режим физической активности и пр.
Техника операции на видео:
Кроме того, человек должен знать, когда можно садиться, так как преждевременная отмена запрета на положение «сидя» – нередкая причина развития повторных деформаций хрящевых структур диска. Обычно запрещается сидеть 4-6 недель, но продолжительность сроков должен устанавливать в любом случае врач. Также вы обязаны носить корсет для позвоночника, который поможет быстрее восстановиться проблемному отделу и внести свою лепту в профилактику последствий. А вот относительно того, как долго ортопедическое устройство придется использовать, тоже определяется сугубо компетентным специалистом с учетом клинических данных по динамике восстановления.
Кто-то восстанавливается согласно плану – через 3 месяца, а кому-то может понадобиться и увеличить длительность восстановительного периода еще на несколько месяцев. Сроки напрямую зависят от индивидуальных особенностей организма к функциональному восстановлению, дооперационного состояния больного, объема и сложности проведенной операции. Но и после выздоровления делайте регулярно зарядку и соблюдайте все меры предосторожности. Не подвергайте себя недопустимым нагрузкам, так как даже поднятие тяжеловесного предмета способно вернуть заболевание.
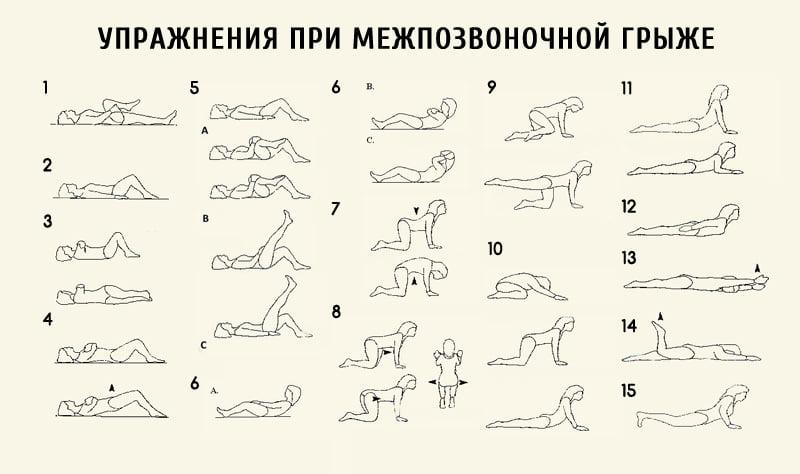
Этот комплекс выполняется как до, так и после операции. Но с согласия врача.
Остаточные боли могут еще какой-то период сохраняться, особенно у людей, поступивших в лечебное учреждение изначально с серьезными вертеброгенными нарушениями, которые прогрессировали слишком продолжительное время. По мере восстановления нервной ткани и мышечных структур неприятные симптомы, не устранившиеся сразу после вмешательства, постепенно будут утихать. Но примите к сведению, что сами по себе, без надлежащего послеоперационного лечения, они не только не пройдут, но и могут приобрести стойкую хроническую форму, иногда с необратимым характером.
Будьте бдительны! Если вас беспокоит боль после удаления грыжи, нужна консультация нейрохирурга! Не пытайтесь связываться с онлайн-докторами через интернет, они вам ничем не помогут, так как не имеют ни малейшего представления об особенностях вашего клинического случая, нюансах хирургического вмешательства, специфике вашего восстановления.
Все хотят получить ответ на наиболее волнующий вопрос: опасна ли операция по поводу грыжи позвоночника? Абсолютно у каждого оперативного метода лечения есть риски возможного развития осложнений. В нашем случае опасность операции тоже не исключается, и в доминирующем количестве она состоит в появлении рецидива, который решается повторным вмешательством. Безусловно, особенное значение еще играет качество интраоперационного сеанса, но, как правило, в преуспевающих клиниках операция проходит благополучно.
Уважаемый доктор Антон Епифанов, один из немногих в русскоязычной среде подробно объясняет опасность операций на позвоночнике, за что ему большая благодарность:
Какими могут быть интраоперационные последствия? Преимущественно они связаны с ранением нерва или твердой мозговой оболочки спинного мозга.- Первое осложнение будет проявляться болями и нарушением чувствительности в ногах или руках, в зависимости от места нахождения травмированного нерва. Если нервная структура повреждена сильно, прогноз на ее восстановление, к сожалению, неутешительный.
- При повреждении твердой спинномозговой оболочки, если хирург своевременно обнаружил причиненный дефект, он его ушьет. В противном случае будет вытекать спинномозговая жидкость. Нарушенная циркуляция ликвора вызовет проблемы с внутричерепным давлением и, как следствие, пациент будет испытывать сильные головные боли. Твердая оболочка может зажить самостоятельно, примерно за 2 недели.
Негативные реакции бывают и послеоперационными, ранние и поздние:
- К ранним осложнениям относят гнойно-септические процессы, в числе которых эпидурит, остеомиелит, нагноение шва, пневмония. Кроме того, в группу ранних постоперационных последствий входят тромбоз глубоких вен нижних конечностей и тромбоэмболия легких.
- Поздние негативные реакции – это повторные рецидивы, вторичные дегенеративно-дистрофические патологии. Сюда же входят грубые рубцово-спаечные разрастания, которые в свою очередь сдавливают нервные образования, что, как и при межпозвоночных грыжах, проявляется болевым синдромом и/или парестезиями, распространяющимися по ходу защемленного нерва.
Если операция проходила на образцовом уровне, соблюдены все профилактические меры и безупречно выполняются врачебные рекомендации, вероятность возникновения любых последствий сводится к самому предельному минимуму.
источник
Удаление грыжи является одним из способов лечения патологии наряду с консервативной терапией. Хирургия применяется в двух случаях: когда медикаментозное лечение не дает эффекта, и когда грыжу можно вылечить только с помощью операции, например при ущемлении. Важно знать, что полностью излечить грыжу можно только с помощью операции. Так, вмешательство устраняет и причину, и следствие заболевания.
- малоинвазивной , когда не требуется серьезного вмешательства в организм больного;
- инвазивной – ряд операций, которые требуют глубокое вмешательство в орган пациента.
Существуют относительные и абсолютные показания к операции. Первые возникают в том случае, если процедура необходима пациенту, ее проведение оправдано, и она дает стойкий и быстрый эффект. К относительным показаниям относятся более или менее стабильные неосложненные грыжи.
Абсолютные – это те признаки, при наличии которых обязательно проводится операция:
- ущемление любого органа;
- рецидив грыжи;
- послеоперационные выпячивания;
- отсутствие эффекта от консервативного лечения;
- серьезные нарушения функции органов.
Противопоказания – это ряд признаков, которые определяют, можно ли проводить операцию или нет:
- обострение имеющихся заболеваний сердца, легких, почек;
- глубокий пожилой возраст;
- инсульт;
- тяжелые формы сахарного диабета;
- сердечная, легочная или печеночная недостаточность;
- беременность;
- коматозные состояния.
Есть множество видов операций на грыже, каждый из которых имеет свои преимущества и недостатки. Кроме того не существует единой правильной и идеальной операции: определенный метод будет хорош при грыже позвоночника, но плох при грыже живота.
Для лечения грыжи хирургическим путем на позвоночном столбе используются такие вмешательства:
Процедура предполагает удаление части или всего позвонка. Она проводится под местной анестезией.
- ориентируясь на среднюю линию спины, хирург делает небольшой разрез на коже, где находится сама грыжа;
- с помощью инструментов отодвигаются поверхностные и глубокие мышцы спины, что обнажает позвонки;
- для получения доступа к проблемным местам позвонка специалист нередко удаляет его часть;
- после получения полного доступа к пораженному месту, врач удаляет часть соединительной ткани и собственно грыжу.
Пациент выписывается из больницы в среднем через две недели. Дискэктомия имеет свои недостатки: больной долго восстанавливается, проходит продолжительную реабилитацию, есть высокая вероятность развития воспалительных процессов. Однако такая операция дешевая, и после ее проведения риск возникновения рецидива крайне мал (до 3% в среднем).
К физическому труду больной не допускается в течение года, к нефизическому – до месяца.
Микрохирургическое удаление межпозвоночного диска.
Такая процедура пользуется популярностью в развитых клиниках мира и считается «золотым стандартом» в области хирургии межпозвонковых дисков.
Микрохирургия проводится под наркозом и использованием операционного микроскопа.
- хирург делает разрез в области грыжи, после чего отодвигает локальные мышцы;
- для полного изучения содержимого врач удаляет часть желтой связки;
- получив доступ, главная задача для хирурга – убрать часть или целый межпозвоночный диск, после чего ушивается рана и накладываются швы.
Преимущества: локальные нервные структуры почти никогда не повреждаются, быстрое восстановление, выписка из больницы на третий день, эффективное купирование болей. Вернуться к прежнему образу жизни пациент сможет уже через месяц, тогда же ему разрешается заниматься физическим трудом. Недостатки: операция дорогая, в среднем ее стоимость составляет 70-ти тысяч рублей, риск рецидива достигает 15-ти процентов.
Эта операция на диске относится к малоинвазивным методам, и проводится под местной анестезией. Суть операции – это снижение давления на нервные корешки. В режиме реального времени под рентгеновским аппаратом вводится несколько тонких и маленьких игл. С помощью этих игл врач воздействует на грыжу лазерным и плазменным излучением, которым разрушается дисковая ткань.
Достоинства: низкая вероятность осложнений и последствий, быстрая реабилитация, пациент возвращается к прежней жизни уже через несколько часов после операции. Большие грыжи – единственный недостаток нуклеопластики, так как с ее помощью можно удалить выпячивание не более семи миллиметров.
Удаление грыжи лазером – вапоризация.
Процедура представляет собой процесс облучения поврежденного диска с помощью специального лазера. Разрушение пораженных тканей проводится путем испарения. Такой способ снижает давление на нервные волокна.
Вапоризация проводится людям от 20 до 60 лет. Слабые места операции: проведение возможно лишь на первых стадиях развития недуга, не проводится на грыжах больше шести миллиметров.
Преимущества: вмешательство оказывает лечебный и профилактический эффект, быстрое исполнение (до 30 минут), через два часа пациент выписывается. 5. Реконструкция диска – так же лазерное удаление грыжи. Операция проводится в неразрушительном режиме. В ходе вмешательства используется облучение поврежденного диска. Так, нагрев диска до высоких температур стимулирует регенерацию хрящевой ткани и восстановление диска.
После операции, спустя шесть месяцев, восстановленные соединительные волокна заполняют межпозвоночное пространство, что способствует исчезновению болевого синдрома в спине. К недостаткам относится дороговизна операции. Преимущества те же, что и при вапоризации.
Разрушение болевых рецепторов.
Суть операции заключается в деструкции и последующем отключении болевых рецепторов в межпозвоночной области. Она наиболее эффективна при фасеточном синдроме. Процедура компактна: местная анестезия, длительность – до 30 минут, спустя час больной освобождается.
Эндоскопическое удаление грыжи.
Эндоскопия относится к малоинвазивным методам удаления. В ходе процедуры используются электронно-оптические инструменты, которые вводятся в позвонок с помощью миниатюрной иглы. После введения эндоскопа, хирург удаляет часть поврежденного диска, высвобождая нервное волокно от компрессии и понижая давление. В результате вмешательства из диска удаляется воспалительная жидкость, понижается давление на позвонок и восстанавливается его структура.
К преимуществам можно отнести: минимальное вмешательство, отсутствие рубцов после операции, быстрое восстановление (через день больной выписывается из стационара).
Пациенту разрешается приступать к умственному труду через неделю, к физическому – спустя месяц. Заниматься простой гимнастикой и легкой физкультурой человеку можно через 14 дней.
Хирургия грыж живота проводится несколькими способами.
Герниопластика по Лихтенштейну.
Такой вариант лечения грыжи относится к ненатяжным. Вмешательство проводится под спинальной анестезией. В месте расположения грыжи на коже делается разрез длиною не более 5 сантиметров. Далее хирург рассекает ткани до тех пор, пока не получит доступ к выпиранию, после чего удаляет грыжу. После этого специалист ушивает ткани. В ходе процедуры используется медицинский материал – хирургическая сетка для грыжи.
Сетка при операции грыжи играет роль соединителя двух краев раны. Достоинства: низкая вероятность осложнений, отсутствие болей, относительно короткий реабилитационный срок, вариативность анестезии (в случае аллергии, врач подбирает индивидуальный способ обезболивания). Недостатки: существует риск повреждения нервных волокон и связок, остается рубец в месте разреза, вероятность развития инфекционного воспаления. Сколько стоит удалить грыжу таким способом? Такая пластика грыжи имеет средний ценник в 20 тысяч рублей.
Этот способ применяется к послеоперационным грыжам. В ходе операции врач создает доступ к грыже, рассекая кожу в поперечном разрезе. Затем хирург вскрывает грыжевой мешок, осматривает содержимое и отделяет его от окружающих тканей. Отсечение органа от стенок мешка занимает целый этап, так как иногда в грыжевом мешке формируются целые слепки из окружающих тканей и органов. В конце вмешательства хирург выполняет аллопластику сетчатым материалом.
Грыжесечение методом Бассини.
Наиболее часто способ Бассини используется при паховых косых и прямых грыжах. Оперативный процесс проводится под местной анестезией. В ходе операции хирург делает стандартные действия: надрезает кожу, получает доступ к выпячиванию, вправляет его, удаляет лишние ткани и ушивает рану.
Способ Мейо считается натяжной операцией. Нередко его применяют в лечении грыж белой линии живота и грыж пупка. В процессе вмешательства специалист постепенно рассекает шары тканей и вскрывает мешок грыжи. После чего хирург вправляет органы в место нормального его расположения и зашивает внешний разрез. Преимущества натяжных и ненатяжных операций: не наносит грубых травм организму.
Недостатки: существует вероятность рецидивов, продолжительная реабилитация, после операции пациент испытывает боль в области раны.
В основном лапароскопические операции при грыжах применяются для паховых выпячиваниях. Грыжа удаляется путем введения в брюшную полость лапароскопа, имеющего маленькую видеокамеру и осветительный прибор. Камера передает изображение на монитор, на котором врач осматривает внутреннюю среду. Двумя другими трубками производится удаление.
Вмешательство выполняется под наркозом. Сколько длится операция по удалению грыжи? Лапароскопический метод требует не больше одного часа. Выписывают пациента уже на следующий день. К прежнему образу жизни человек возвращается спустя несколько недель.
Достоинства лапароскопического метода: отсутствие массивных рубцов в месте проколов, после операции пациент не жалуется на боли, быстрая реабилитация, низкая вероятность рецидива и осложнений. От 15 до 50 тысяч рублей – вот, сколько стоит операция лапароскопическим методом.
Всякое вмешательство – это стресс и напряжение для организма: даже самая простая операция способна вызвать последствия.
Выделяются такие разновидности послеоперационных осложнений:
- повреждение органов, которое появляется при работе с сечением грыжевого мешка. Хирург может случайно задеть окружающие ткани, нарушив тем самым тканевую целостность органа;
- тромбоз вен нижних конечностей. Чаще всего это явление встречается у пожилых людей;
- образование кровяных сгустков под кожей – гематом;
- рецидив – повторное возникновение грыжи из-за плохого ушивания краев раны;
- повреждение в ходе операции нервных волокон;
- занесение в рану инфекций;
- обострение остеохондроза, если таковой имеется;
- воспалительные процессы в месте оперативного вмешательства;
- паралич или парез конечностей, что вызывается повреждением спинного мозга после устранения межпозвоночного диска.
Развитие осложнений зависит от нескольких факторов: компетентность хирурга, стойкость организма больного, соблюдение врачебных указаний и режима питания.
Хирургическая операция несет полноценный результат тогда, когда пациент старательно проходит курс реабилитации. В ходе восстановления врач назначает больаному комплекс гимнастических упражнений, физиотерапевтические процедуры, также для полноценной реабилитации имеет значение диета. В среднем восстановление больного длится до трех недель. Сроки прямо зависят от типа операции, которая была проведена.
источник
Ежегодно в мире инсульт переносят более 6 млн человек. Эта патология является основной причиной стойкой утраты трудоспособности.
В последние годы во всем мире прогрессивно возрастает количество мозговых инсультов (МИ), в первую очередь за счет ишемических нарушений мозгового кровообращения. В ближайшие десятилетия эксперты ВОЗ предполагают дальнейший рост количества ишемических.
По определению ВОЗ, инсульт – это внезапно развившиеся клинические симптомы локального или генерализованного нарушения мозговых функций, длящиеся 24 часа и более или приводящие к смерти пациента в результате сосудистых нарушений.
Ключевая роль атеротромбоза сосудов в формировании сосудистой мозговой недостаточности, вплоть до развития острого инсульта, в настоящее время не вызывает сомнений.
В данной статье, рассчитанной на практических врачей, которые занимаются лечением острого периода инсультов, показаны преимущества и область применения тромболитической терапии с рекомбинантным тканевым активатором плазминогена (rtPA).
28 января 2003 года в операционной межобластного центра трансплантации Запорожской областной клинической больницы было людно. Бригады хирургов тщательно готовились к очередной уникальной операции — пересадке сердца. Вот так же людно.
Официальное руководство Американской ассоциации сердца (AHA), Совета по инсульту Американской ассоциации инсульта (ASA) поддержано Советом по сердечно-сосудистой рентгенологии и вмешательству, а также Американской академией неврологии (AAN)
В мире ежегодно регистрируется около 15 млн инсультов, в связи с инсультами умирают более 5,5 млн человек.
Дипиридамол в сочетании с аспирином был разработан для вторичной профилактики ишемического инсульта и транзиторных ишемических атак.
После инсульта или тяжелых травм руки с повреждением нервов и сухожилий восстановление функций конечности – трудная задача, требующая долгих месяцев упорных тренировок. Облегчить реабилитацию таким больным поможет особая «роботическая» перчатка.
Уникальный для медицины случай произошел в Англии: женщину, ожидавшую ребенка, сразил инсульт. Врачам удалось совершить чудо: он спасли жизни обеих: и самой больной, и ее новорожденной дочки – мать впервые увидела дитя, когда ему было уже 7 недель.
Во многих странах врачи назначают больным, которым предстоит хирургическая операция, прием ацетилсалициловой кислоты за несколько дней до планируемого вмешательства. Но ученые из Австралии считают подобную практику вредной.
Хотя кровоизлияния в мозг случают реже, чем ишемические инсульты, вызванные непроходимостью кровеносного сосуда головного мозга, они тоже уносят ежегодно множество человеческих жизней. Ученые из США разработали новый метод лечения таких инсультов.
Тотальное эндопротезирование тазобедренного сустава – тяжелая, но жизненно необходимая операция. Голландские ученые предупреждают лечащих врачей о повышенной опасности развития инсультов у таких пациентов, причем инсультов обоих видов.
Американские врачи утверждают, что ими получены данные об убедительном преимуществе операции аортокоронарного шунтирования при лечении ишемической болезни сердца, отягощенной диабетом, по сравнению с баллонной ангиопластикой и стентированием.
В США и Канаде прошли исследования безопасности нового препарата NA-1, который способен улучшить исход лечения ишемического инсульта. Для множества больных блеснул луч надежды, но для точной оценки эффективности NA-1 понадобятся новые испытания.
В канун плановой хирургической операции врачи предупреждают больного о необходимости воздерживаться от употребления пищи и обычно назначают очистку кишечника. А ученые из США обнаружили, что на исход вмешательства заметно влияет и потребление белка.
Даже безукоризненное выполнение хирургической операции не гарантирует благополучного исхода – угрозу жизни пациента могут представлять различные осложнения. Некоторые из них можно предсказать с помощью новой методики, созданной учеными из Лондона.
источник
*Импакт фактор за 2017 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Инсульт – одно из наиболее опасных осложнений хирургических вмешательств. Чтобы научиться предотвращать, а при необходимости – правильно лечить интраоперационные и послеоперационные инсульты, врачи должны иметь четкое представление о факторах риска их возникновения. В статье приведены современные данные о патофизиологии инсультов, развивающихся в интраоперационном и послеоперационном периодах, а также рекомендации, касающиеся стратификации риска таких инсультов и коррекции факторов риска.
Распространенность
Частота встречаемости интраоперационных и послеоперационных инсультов зависит от типа и сложности проводимого хирургического вмешательства. Риск возникновения инсульта после общехирургических операций очень низок, в то время как кардиоваскулярные операции, в том числе комбинированные, сопряжены с высокой вероятностью его развития (табл. 1) [1–7]. Большое значение придается и продолжительности хирургического вмешательства. Кроме того, инсульты чаще развиваются после экстренных, а не плановых операций [1].
Несмотря на успехи современной хирургии и улучшение качества ухода за послеоперационными больными, частота встречаемости интраоперационных и послеоперационных инсультов не снижается, что объясняют старением населения и увеличением числа пациентов с сопутствующими заболеваниями, которым предстоит операция. Возникновение инсультов во время и после операций продлевает сроки госпитализации, обусловливает инвалидизацию, требует длительного лечения, а также может привести к летальному исходу [7].
Патофизиология
Результаты радиологических и патологоанатомических исследований говорят о том, что интраоперационные и послеоперационные инсульты являются в основном ишемическими и эмболическими [8–10]. Так, по данным исследования, которое было проведено у 388 пациентов с инсультами, развившимися после аорто–коронарного шунтирования (АКШ), геморрагический инсульт выявляется в 1% случаев, а эмболический – в 62% (рис. 1) [11]. Сроки возникновения эмболических инсультов характеризуются бимодальным распределением: примерно 45% таких инсультов развиваются на следующий день после операции [1,11], а оставшиеся 55% – после выхода из анестезии, начиная со второго дня [1,11]. Ранняя эмболия обусловлена вмешательствами на сердце и аорте или высвобождением твердых частиц из аппарата искусственного кровообращения [1,7,13]. Отсроченная эмболия чаще происходит на фоне фибрилляции предсердий в послеоперационном периоде, инфаркта миокарда, вызванного дисбалансом между потреблением и расходом кислорода, и коагулопатий [13]. Хирургическая травма и ассоциированное с ней повреждение тканей провоцирует усиление свертываемости крови. Согласно результатам различных исследований, после операции система свертывания крови стимулируется, а фибринолиз подавляется, о чем свидетельствует подавление активности тканевого активатора плазминогена и усиление активности ингибитора активатора плазминогена 1 типа, а также повышение содержания продуктов деградации фибриногена – комплекса тромбин–антитромбин, белка–предшественника тромба и D–димера – сразу после хирургического вмешательства и вплоть до 14–21 дня послеоперационного периода [14–16]. Общая анестезия, дегидратация, постельный режим, стаз в послеоперационном периоде, отказ от антитромбоцитарной и антикоагулянтной терапии во время и после операции еще больше усиливает состояние гиперкоагуляции, вызванное хирургическим вмешательством, и повышает риск возникновения тромботических явлений, в том числе и инсульта.
После АКШ наблюдаются непродолжительные и длительные когнитивные расстройства, проявляющиеся в форме кратковременной потери памяти, ограничения физической активности и психомоторной заторможенности [7]. Причины этих явлений комплексны, их провоцируют ишемическое повреждение вследствие микроэмболизации, хирургическая травма, предшествующие сосудистые изменения и колебания температуры во время операции.
В противоположность традиционным представлениям при операциях на сердце, а также вмешательствах по поводу стеноза сонных артерий развитие инсульта не связано с гипоперфузией. Искусственная гипотензия, обусловленная анестезией, не оказывает отрицательного влияния на перфузию головного мозга и не увеличивает риск интраоперационных и послеоперационных инсультов из–за гипоперфузии при вмешательствах по поводу стеноза сонных артерий [6,11,15]. У большинства таких пациентов чаще возникают эмболические инсульты на противоположной стороне или двусторонние инсульты (рис. 2), т.е. их появление нельзя объяснить только за счет стеноза сонных артерий [6]. По данным другого исследования, лишь 9% инсультов после АКШ происходит в зонах гипоперфузии головного мозга [11]. Как и следовало ожидать, большинство таких инсультов случилось в первый день после операции. При гипоперфузии отсроченные инсульты зачастую развиваются на фоне дегидратации в послеоперационном периоде или кровопотери. Реже инсульт провоцирует воздушная, жировая или парадоксальная эмболия, а также нарушение целостности стенки артерии при проведении анестезии или выполнении операций в области шеи (табл. 2).
Стратификация риска
Повышение риска инсульта во время и после хирургических вмешательств связано со статусом пациента и особенностями самой операции (табл. 3) [2,4,6,8,13, 15,16]. Для оптимизации лечения у каждого больного перед операций необходимо соотнести эффективность с потенциальным риском. Существует несколько моделей для стратификации риска интраоперационных и послеоперационных инсультов [7,17]. Используя методику ступенчатого перехода, исследователи из Группы по изучению сердечно–сосудистых заболеваний севера Новой Англии разработали модель для прогнозирования риска развития инсульта после АКШ, в которой каждый из 7 признаков, оцениваемых до операции, имеет свой уровень значимости. Эти признаки были выделены на основании клинических наблюдений за 33062 пациентами, которым предстояло АКШ [17]. Основные данные по этой прогностической модели суммированы в таблице 4 [18].
Коррекция факторов риска
Осуществляя различные диагностические и лечебные мероприятия, можно скорректировать факторы риска, чтобы предотвратить интраоперационные и послеоперационные инсульты и минимизировать показатели заболеваемости. Серьезным фактором риска является наличие в анамнезе инсульта или транзиторной ишемической атаки (ТИА) [2,4, 6–8,12,13,17]. Поэтому очень важно подробно собрать анамнез, а при наличии указаний на инсульт или ТИА, произошедшие в предыдущие 6 месяцев – постараться установить их причину и провести соответствующее лечение. Это приобретает особое значение в тех случаях, если такая оценка не проводилась или была неполной, или же если после инсульта/ТИА в неврологическом статусе пациента произошло ухудшение. Зачастую в первые дни после инсульта резервы кровоснабжения головного мозга снижены, поэтому до проведения планового хирургического вмешательства должно пройти достаточное время для того, чтобы гемодинамика и неврологический статус больного успели стабилизироваться.
Симптоматический стеноз сонных артерий также ассоциируется с высоким риском интраоперационных и послеоперационных инсультов [6,19]. В этих случаях выполняют ультразвуковое доплеровское исследование сонных артерий; если симптоматический стеноз сонных артерий возник не позднее, чем за 6 месяцев до момента обследования, перед кардиоваскулярной операцией целесообразно предпринять реваскуляризирующее вмешательство [20]. У пациентов с сочетанным поражением сердца и сонных артерий, которым предстоит экстренная операция на сердце (у таких пациентов вероятность развития осложнений и гибели из–за заболевания сердца гораздо выше, чем риск инсульта), можно провести комбинированное вмешательство (реваскуляризация сонных артерий одновременно с АКШ) или две последовательные операции в обратной последовательности (реваскуляризация сонных артерий после АКШ). Однако комбинированный метод ассоциируется с большей распространенностью инсультов [23]. Безопасность эндартерэктомии по сравнению со стентированием сонных артерий дискутируется. Предварительные результаты исследований по этому вопросу свидетельствует о том, что при сочетанном симптоматическом стенозе сонных артерий и поражении коронарных сосудов у пациентов, которым на первом этапе предстоит реваскуляризация сонных артерий, лучше, по–видимому, выполнить стентирование [22].
Влияние бессимптомного стеноза сонных артерий, в особенности монолатерального, на вероятность развития интраоперационных и послеоперационных инсультов, зачастую преувеличено. Данные научной литературы за период с 1970 по 2000 гг. показывают, что риск возникновения инсульта после АКШ в целом составляет 2%, при бессимптомном стенозе просвета одной из общих сонных артерий на 50–99% – 3%, при двустороннем стенозе просвета обеих общих сонных артерий на 50–99% – 5%, а при окклюзии сонных артерий – 7% [6]. В 60% случаев развитие интраоперационных и послеоперационных инсультов у больных со стенозом сонных артерий связано с другими причинами [6].
Бессимптомный стеноз сонных артерий можно заподозрить при предоперационном обследовании на основании выслушивания шума в области сосудов шеи. Поскольку выслушивание такого шума само по себе не сопряжено с высоким риском инсульта и не коррелирует с выраженностью стеноза сонных артерий [23], проведение ультразвукового допплеровского исследования в этих ситуациях не показано. Однако если в анамнезе имеются указания на ТИА, то выполнение такого исследования может быть вполне обоснованным. Далее, лишь немногие данные указывают на необходимость осуществления профилактической реваскуляризации по стандартной методике у пациентов с бессимптомным стенозом сонных артерий, которым предстоит обширная кардиоваскулярная операция [24].
Проведение реваскуляризации сонных артерий до выполнения кардиоваскулярного хирургического вмешательства, как правило, нецелесообразно, поскольку риск возникновения интраоперационных и послеоперационных инсультов и инфаркта миокарда во время этой процедуры повышается в 2 раза, а вероятность развития инсульта во время более обширной операции практически не уменьшается [6,19,20]. Тем не менее у некоторых пациентов с гемодинамически значимым выраженным бессимптомным стенозом сонных артерий (в особенности двусторонним) целесообразно осуществить реваскуляризацию сонных артерий перед плановой операцией на сердце. Таким образом, выбор тактики ведения при выявлении бессимптомного стеноза сонных артерий должен быть дифференцированным. Перед операцией следует, как минимум, провести углубленное неврологическое обследование, подробно собрать анамнез (стараясь обнаружить симптомы ТИА, о которых пациент раньше не упоминал), а также выполнить компьютерную томографию (КТ) или магнитно–резонансную томографию (МРТ) головного мозга с целью исключить «молчащие» ипсилатеральные инфаркты. Дополнительные методы обследования, такие как ультразвуковое допплеровское исследование сосудов головного мозга, КТ–ангиография или магнитно–резонансная ангиография, помогают выявить микроэмболии, определить скорость кровотока в сосудах головного мозга, обнаружить гемодинамически значимый стеноз сонных артерий [25,26] и отобрать тех больных, которым перед более обширной операцией может быть показана реваскуляризация сонных артерий. Однако клиническая и экономическая целесообразность исследовать гемодинамику до операции на сердце многими оспаривается, и поэтому до того, как включить эти диагностические процедуры в стандартные протоколы предоперационного обследования пациентов со стенозом сонных артерий, их нужно еще усовершенствовать и ратифицировать.
Атеросклероз аорты – это объективный прогностический фактор риска интраоперационных и послеоперационных инсультов, особенно у пациентов, которым предстоит операция на сердце и реваскуляризация левой венечной артерии [1,13]. Уточнить тактику хирургического лечения позволяет чреспищеводная эхокардиография или интраоперационное эпиаортальное ультразвуковое исследование, с помощью которого можно определить размеры и локализацию бляшек в аорте и на основании полученных данных изменить зону катетеризации аорты или наложения зажима с целью «обойти» кальцинированную бляшку. Проведение катетеризации аорты [27] или внутриаортальной фильтрации [28] под контролем эхокардиографии во время АКШ снижает риск интраоперационных и послеоперационных инсультов.
Систолическая дисфункция увеличивает вероятность развития инсульта во время и после операции, особенно при сопутствующей фибрилляции предсердий [13]. Эхокардиография, проводимая в предоперационном периоде для оценки фракции выброса, визуализации внутрисердечных эмболов и выявления признаков атеросклероза аорты, дает возможность стратифицировать риск инсульта и изменить тактику лечения пациентов с сердечной недостаточностью, фибрилляцией предсердий или при подозрении на пороки клапанов сердца, если на следующем этапе предполагается реваскуляризация левой венечной артерии.
Фибрилляция предсердий развивается у 30–50% пациентов, перенесших операцию на сердце. Чаще всего она возникает на второй и четвертый дни после хирургического вмешательства и служит основной причиной интраоперационных и послеоперационных инсультов [1,8,9,13,17,18,29]. Электролитный дисбаланс и повышение объема внутрисосудистой жидкости, наблюдающиеся в послеоперационном периоде, усиливают эктопическую активность предсердий, что предрасполагает к появлению аритмий (табл. 5) [29]. Поэтому очень важно на протяжении, как минимум, трех дней после операции на сердце проводить мониторинг сердечной деятельности для исключения аритмий, а также корректировать электролитный дисбаланс и объем внутрисосудистой жидкости. Частоту встречаемости послеоперационных фибрилляции предсердий и инсультов можно снизить за счет профилактического введения амиодарона и b–адреноблокаторов, которое начинают за 5 дней до хирургического вмешательства [30]. Пациентам с уже существующей фибрилляцией предсердий назначают антиаритмические препараты или лекарственные средства, контролирующие частоту сердечных сокращений, которые продолжают давать и в послеоперационном периоде, дополняя при необходимости внутривенным введением. Никаких специальных клинических испытаний, посвященных изучению целесообразности использования антикоагулянтов при вновь возникшей в послеоперационном периоде фибрилляции предсердий (которая зачастую спонтанно исчезает через 4–6 недель), не проводилось. Пациентам с высоким риском развития интраоперационных и послеоперационных инсультов (например, при наличии инсульта или ТИА в анамнезе), у которых после хирургического вмешательства возникла фибрилляция предсердий, эксперты Американской коллегии торакальной медицины рекомендуют начинать гепаринотерапию и проводить ее в течение 30 дней после восстановления нормального синусового ритма [31].
Прекращение приема варфарина или других антитромбоцитарных средств перед операцией повышает риск интраоперационных и послеоперационных инсультов [32, 33]. Вероятность их развития особенно высока при наличии ишемической болезни сердца [33]. Изучение исходов хирургических вмешательств у больных, нуждающихся в длительной терапии варфарином, свидетельствует о том, что частота встречаемости тромбоэмболий варьирует в зависимости от тактики лечения: при прекращении приема варфарина в отсутствие внутривенного введения гепарина она составляет 0,6%, а в случае внутривенного введения гепарина тромбоэмболий не бывает [34]. При приеме варфарина в терапевтической дозировке значительные кровотечения на фоне стоматологических манипуляций наблюдаются в 0,2% случаев, а при пункциях суставов, операциях по поводу катаракты, эндоскопии и колоноскопии с биопсией или без таковой кровотечений вообще не наблюдается.
Клинические исследования в группе больных с высоким риском тромбоэмболий, которым предстояло эндопротезирование коленного или тазобедренного суставов, продемонстрировали, что прием варфарина в небольшой терапевтической дозировке (международное нормализованное отношение от 1,8 до 2,1) в предоперационном периоде безопасен и является эффективным методом профилактики эмболических явлений [35]. Эти данные позволяют предположить, что в ходе подготовки больного к стоматологическим манипуляциям, артроцентезам, операциям по поводу катаракты, диагностическим эндоскопическим процедурам и даже ортопедическим операциям нет необходимости отменять антитромбоцитарные средства или антикоагулянты. Если же от приема антикоагулянтов перед проведением других инвазивных вмешательств все же приходится отказываться, то эти сроки, по возможности, должны быть минимальными. После отмены варфарина рекомендуется начать гепаринотерапию и уже в раннем послеоперационном периоде возобновить лечение антикоагулянтами. Особенно это касается пациентов с высоким риском тромбоэмболий (например, при наличии системных эмболий или фибрилляции предсердий в анамнезе, а также искусственных клапанов сердца) [36].
Продолжительность хирургического вмешательства по возможности следует сократить. Более длительные вмешательства ассоциированы с большим риском развития интраоперационных и послеоперационных инсультов. Кроме того, при выборе хирургической тактики необходимо учитывать и профиль риска у данного конкретного больного. Среди пациентов с низкой фракцией выброса риск возникновения инсульта при проведении ангиопластики коронарных сосудов меньше, чем при АКШ [37]. В группе больных с атеросклерозом аорты использование аппарата искусственного кровообращения во время АКШ повышает вероятность развития инсульта по сравнению с выполнением АКШ без этого устройства [38]. При атеросклерозе дуги аорты предпочтительна бесконтактная («no–touch») технология АКШ, не связанная с манипуляциями на восходящей части дуги аорты [39].
Также необходимо принимать во внимание метод оказания анестезиологического пособия и разновидность используемого препарата. Регионарная анестезия сопряжена с меньшей вероятностью развития послеоперационных осложнений, чем общая анестезия [40]. Есть данные, что изофлуран и тиопентал натрия могут обладать нейропротекторным действием [41].
Активно дискутируется и вопрос о том, каким должен быть оптимальный уровень артериального давления (АД) в ходе хирургического вмешательства [12, 17]. Так, согласно результатам одного из исследований, частота встречаемости сердечно–сосудистых и неврологических осложнений (в том числе инсульта) гораздо ниже, если среднее АД в ходе АКШ поддерживается в интервале 80–100 мм рт.ст., а не 50–60 мм рт.ст. (т.е. повышенное среднее АД более безопасно для проведения АКШ и улучшает исходы) [42]. Уровень АД во время операции нужно оценивать в сочетании с его значением в предоперационном периоде; изменение АД на 20 мм рт.ст. и более (20% и более) по сравнению с предоперационным уровнем ассоциируется с высоким риском интраоперационных и послеоперационных осложнений [43]. Приведение интраоперационных и послеоперационных показателей АД в соответствие с его предоперационными значениями позволяет снизить вероятность возникновения инсульта и летального исхода [27].
Температура тела также влияет на послеоперационные исходы. Если в ходе АКШ температура тела поддерживается на уровне не выше 31,4–33,1°С, то частота встречаемости интраоперационных и послеоперационных инсультов заметно уменьшается [44]. Однако в этих случаях выше вероятность смерти больного. Таким образом, чтобы избежать быстрого согревания и гипертермии после завершения АКШ и минимизировать тем самым риск появления когнитивных расстройств в послеоперационном периоде, наиболее целесообразно поддерживать гипотермию на уровне 34°С [44].
Гипергликемия (как во время, так и после операции) коррелирует с высокой распространенностью фибрилляции предсердий, инсульта и смерти [45]. В ходе операции и в послеоперационном периоде необходимо строго контролировать содержание глюкозы в крови. Введение инсулина и калия во время и после операции с целью поддержания концентрации глюкозы не выше 140 мг/дл (7,8 ммоль/л) улучшает исходы хирургического вмешательства [46].
И в предоперационном, и в послеоперационном периодах всегда нужно проводить профилактику и лечение инфекций и воспалительных процессов. Лейкоцитоз сопряжен с высоким риском инсультов, плохими исходами и возможностью развития фибрилляции предсердий после хирургического вмешательства [47,48].
Систолическая дисфункция и аритмии, возникающие в послеоперационном периоде, ассоциированы с высокой частотой встречаемости инсультов [1, 7–9]. Поэтому после операции нужно не только восстанавливать электролитный баланс и объем внутрисосудистой жидкости, но и четко отслеживать симптомы сердечной недостаточности и аритмий. В послеоперационном периоде показана ранняя мобилизация пациента и проведение мероприятий, направленных на профилактику тромбоза глубоких вен нижних конечностей. После шунтирования со сбросом крови справа налево иногда развивается парадоксальная эмболия, которая может стать причиной инсульта.
Наконец, есть данные, что прием антитромбоцитарных средств после хирургических вмешательств на сердце и сонных артериях снижает распространенность интраоперационных и послеоперационных инсультов, не повышая при этом частоту осложнений, связанных с кровотечениями [49, 50]. Кроме того, в предоперационном периоде вне зависимости от показателей липидного профиля целесообразно назначать статины, что позволяет уменьшить риск инсультов у пациентов, которым предстоит кардиоваскулярная операция [51].
Лечение
Пациентам, которые ранее перенесли обширные операции, внутривенное введение тканевого активатора плазминогена противопоказано из–за высокого риска кровотечений. Альтернативой для таких больных служат внутриартериальное введение тканевого активатора плазминогена и эндоваскулярная механическая ретракция сгустка. Результаты серии экспериментов свидетельствуют о том, что внутриартериальное введение тромболитиков не позднее, чем через 6 часов после инсульта, является достаточно безопасной процедурой [52,53]. По данным исследования, проводившегося среди 36 пациентов, которым после инсульта внутриартериально вводили тканевой активатор плазминогена, частичную или полную реканализацию удалось осуществить в 80% случаев, причем у 38% больных симптоматика полностью купировалась или же осталось лишь незначительное ограничение трудоспособности. Показатели смертности в этой группе оказались аналогичны таковым у непрооперированных пациентов, которым проводили внутриартериальный тромболизис [53]. Кровотечения из операционной раны, большинство из которых были незначительными, наблюдались в 17% случаев. У 25% больных произошли внутричерепные кровоизлияния, однако ухудшения в неврологическом статусе отмечены только в 8% случаев. Наиболее часто внутричерепные кровоизлияния возникали после трепанации черепа. Применение методов механической тромбэктомии или эмболэктомии после интраоперационных и послеоперационных инсультов подробно не изучено. Однако в послеоперационном периоде использование этих методов может быть целесообразно, особенно в тех случаях, когда внутриартериальный тромболизис противопоказан. Наличие ограничений к проведению подобных процедур лишний раз подчеркивает необходимость своевременно диагностировать интраоперационные и послеоперационные инсульты и немедленно приглашать на консультацию невролога.
Перспективы
Идея предоперационной профилактики инсульта привлекает все большее внимание. Эффективность нейропротекторов, как средств профилактики инсульта и когнитивных расстройств после АКШ, оценивали лишь в ходе нескольких рандомизированных испытаний [54–56]. Считается, что назначение в предоперационном периоде статинов [51] или b–адреноблокаторов [30] снижает распространенность инсультов и когнитивных расстройств после АКШ. Кроме того, есть данные (хотя и противоречивые), что таким же действием обладает антифибринолитический препарат апротинин/контрикал [56]. Полученные результаты свидетельствуют о том, что нейропротекторное лечение, проводимое в предоперационном периоде, может быть эффективно в плане профилактики инсультов, но требует дальнейшего изучения. Чтобы сформулировать наиболее оптимальные стратегии профилактики и лечения интраоперационных и послеоперационных инсультов, нужно дополнительно провести рандомизированные контролируемые испытания.
Реферат подготовлен Е.Б. Третьяк
по материалам статьи M. Selim «Perioperative stroke»
The New England Journal of Medicine Vol. 356: pp. 706–713, No.7, February 15, 2007
Литература
1. Bucerius J, Gummert JF, Borger MA, et al. Stroke after cardiac surgery: a risk factor analysis of 16,184 consecutive adult patients. Ann Thorac Surg 2003;75:472–478. [Free Full Text]
2. Kam PC, Calcroft RM. Peri–operative stroke in general surgical patients. Anaesthesia 1997;52:879–883. [CrossRef][ISI][Medline]
3. Gutierrez IZ, Barone DL, Makula PA, Currier C. The risk of perioperative stroke in patients with asymptomatic carotid bruits undergoing peripheral vascular surgery. Am Surg 1987;53:487–489. [ISI][Medline]
4. Nosan DK, Gomez CR, Maves MD. Perioperative stroke in patients undergoing head and neck surgery. Ann Otol Rhinol Laryngol 1993;102:717–723. [ISI][Medline]
5. Bond R, Rerkasem K, Shearman CP, Rothwell PM. Time trends in the published risks of stroke and death due to endarterectomy for symptomatic carotid stenosis. Cerebrovasc Dis 2004;18:37–46. [ISI][Medline]
6. Naylor AR, Mehta Z, Rothwell PM, Bell PR. Carotid artery disease and stroke during coronary artery bypass: a critical review of the literature. Eur J Vasc Endovasc Surg 2002;23:283–294. [CrossRef][ISI][Medline]
7. McKhann GM, Grega MA, Borowicz LM Jr, Baumgartner WA, Selnes OA. Stroke and encephalopathy after cardiac surgery: an update. Stroke 2006;37:562–571. [Free Full Text]
8. Limburg M, Wijdicks EF, Li H. Ischemic stroke after surgical procedures: clinical features, neuroimaging, and risk factors. Neurology 1998;50:895–901. [Abstract]
9. Restrepo L, Wityk RJ, Grega MA, et al. Diffusion– and perfusion–weighted magnetic resonance imaging of the brain before and after coronary artery bypass grafting surgery. Stroke 2002;33:2909–2915. [Free Full Text]
10. Brooker RF, Brown WR, Moody DM, et al. Cardiotomy suction: a major source of brain lipid emboli during cardiopulmonary bypass. Ann Thorac Surg 1998;65:1651–1655. [Free Full Text]
11. Likosky DS, Marrin CA, Caplan LR, et al. Determination of etiologic mechanisms of strokes secondary to coronary artery bypass graft surgery. Stroke 2003;34:2830–2834. [Free Full Text]
12. Likosky DS, Caplan LR, Weintraub RM, et al. Intraoperative and postoperative variables associated with strokes following cardiac surgery. Heart Surg Forum 2004;7:E271–E276. [CrossRef][ISI][Medline]
13. Hogue CW Jr, Murphy SF, Schechtman KB, Davila–Roman VG. Risk factors for early or delayed stroke after cardiac surgery. Circulation 1999;100:642–647. [Medline]
14. Dixon B, Santamaria J, Campbell D. Coagulation activation and organ dysfunction following cardiac surgery. Chest 2005;128:229–236. [CrossRef][ISI][Medline]
15. Paramo JA, Rifon J, Llorens R, Casares J, Paloma MJ, Rocha E. Intra– and postoperative fibrinolysis in patients undergoing cardiopulmonary bypass surgery. Haemostasis 1991;21:58–64. [ISI][Medline]
16. Hinterhuber G, Bohler K, Kittler H, Quehenberger P. Extended monitoring of hemostatic activation after varicose vein surgery under general anesthesia. Dermatol Surg 2006;32:632–639. [CrossRef][ISI][Medline]
17. van Wermeskerken GK, Lardenoye JW, Hill SE, et al. Intraoperative physiologic variables and outcome in cardiac surgery: Part II. Neurologic outcome. Ann Thorac Surg 2000;69:1077–1083. [Free Full Text]
18. Charlesworth DC, Likosky DS, Marrin CA, et al. Development and validation of a prediction model for strokes after coronary artery bypass grafting. Ann Thorac Surg 2003;76:436–443. [Free Full Text]
19. Gerraty RP, Gates PC, Doyle JC. Carotid stenosis and perioperative stroke risk in symptomatic and asymptomatic patients undergoing vascular or coronary surgery. Stroke 1993;24:1115–1118. [Abstract]
20. Chaturvedi S, Bruno A, Feasby T, et al. Carotid endarterectomy –– an evidence–based review: report of the Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology. Neurology 2005;65:794–801. [Free Full Text]
21. Das SK, Brow TD, Pepper J. Continuing controversy in the management of concomitant coronary and carotid disease: an overview. Int J Cardiol 2000;74:47–65. [CrossRef][ISI][Medline]
22. Yadav JS, Wholey MH, Kuntz RE, et al. Protected carotid–artery stenting versus endarterectomy in high–risk patients. N Engl J Med 2004;351:1493–1501. [Free Full Text]
23. Mackey AE, Abrahamowicz M, Langlois Y, et al. Outcome of asymptomatic patients with carotid disease. Neurology 1997;48:896–903. [Abstract]
24. Birincioglu CL, Bayazit M, Ulus AT, Bardakci H, Kucuker SA, Tasdemir O. Carotid disease is a risk factor for stroke in coronary bypass operations. J Card Surg 1999;14:417–423. [ISI][Medline]
25. Molloy J, Markus HS. Asymptomatic embolization predicts stroke and TIA risk in patients with carotid artery stenosis. Stroke 1999;30:1440–1443. [Free Full Text]
26. Soinne L, Helenius J, Tatlisumak T, et al. Cerebral hemodynamics in asymptomatic and symptomatic patients with high–grade carotid stenosis undergoing carotid endarterectomy. Stroke 2003;34:1655–1661. [Free Full Text]
27. Gold JP, Torres KE, Maldarelli W, Zhuravlev I, Condit D, Wasnick J. Improving outcomes in coronary surgery: the impact of echo–directed aortic cannulation and perioperative hemodynamic management in 500 patients. Ann Thorac Surg 2004;78:1579–1585. [Free Full Text]
28. Wimmer–Greinecker G. Reduction of neurologic complications by intra–aortic filtration in patients undergoing combined intracardiac and CABG procedures. Eur J Cardiothorac Surg 2003;23:159–164. [Free Full Text]
29. Lahtinen J, Biancari F, Salmela E, et al. Postoperative atrial fibrillation is a major cause of stroke after on–pump coronary artery bypass surgery. Ann Thorac Surg 2004;77:1241–1244. [Free Full Text]
30. Crystal E, Garfinkle MS, Connolly SS, Ginger TT, Sleik K, Yusuf SS. Interventions for preventing post–operative atrial fibrillation in patients undergoing heart surgery. Cochrane Database Syst Rev 2004;4:CD003611–CD003611. [Medline]
31. Epstein AE, Alexander JC, Gutterman DD, Maisel W, Wharton JM. Anticoagulation: American College of Chest Physicians guidelines for the prevention and management of postoperative atrial fibrillation after cardiac surgery. Chest 2005;128:Suppl 2:24S–27S. [CrossRef][ISI][Medline]
32. Maulaz AB, Bezerra DC, Michel P, Bogousslavsky J. Effect of discontinuing aspirin therapy on the risk of brain ischemic stroke. Arch Neurol 2005;62:1217–1220. [Free Full Text]
33. Genewein U, Haeberli A, Straub PW, Beer JH. Rebound after cessation of oral anticoagulant therapy: the biochemical evidence. Br J Haematol 1996;92:479–485. [CrossRef][ISI][Medline]
34. Dunn AS, Turpie AG. Perioperative management of patients receiving oral anticoagulants: a systematic review. Arch Intern Med 2003;163:901–908. [Free Full Text]
35. Larson BJ, Zumberg MS, Kitchens CS. A feasibility study of continuing dose–reduced warfarin for invasive procedures in patients with high thromboembolic risk. Chest 2005;127:922–927. [CrossRef][ISI][Medline]
36. Dunn AS, Wisnivesky J, Ho W, Moore C, McGinn T, Sacks HS. Perioperative management of patients on oral anticoagulants: a decision analysis. Med Decis Making 2005;25:387–397. [Free Full Text]
37. O’Keefe JH Jr, Allan JJ, McCallister BD, et al. Angioplasty versus bypass surgery for multivessel coronary artery disease with left ventricular ejection fraction
источник
Инсульт приводит к серьезным осложнениям и смерти. Важно вовремя оказать медицинскую помощь больному человеку. Операция после инсульта головного мозга проводится с целью фиксирования аневризмы, иссечения гематомы, кисты или бляшки. Хирургическое лечение в 85% случаев спасает жизни пациентов. При кровоизлиянии в мозг оказать действенную и эффективную помощь больному человеку реально только в первые 6 часов. В городских больницах функционируют нейрохирургические отделения. Там пациентам оказывается экстренная помощь, проводятся неотложные операции на головном мозге.
Оперативные методики лечения применяются как при геморрагических, так и при ишемических инсультах. Нарушение целостности крупных артерий, разрыв аневризмы, образование атеросклеротических наслоений провоцируют кровоизлияние в мозговую полость. Следствиями инсульта являются бляшки, гематомы и кисты. Они сдавливают ткани, вызывают отек. Задача нейрохирурга — удалить новообразования, предупредить повторный инсульт, восстановить полноценную мозговую деятельность.
Существуют такие виды операций при инсульте головного мозга:
- Трепанация черепа (краниотомия). Открытое хирургическое вмешательство проводится только в 25% случаев. Краниотомия назначается для удаления объемных новообразований, при отеках, рецидивах патологического состояния.
- Клипирование аневризмы. Через небольшой разрез на коже в бедренную артерию вводится катетер. Он движется по кровотоку до места повреждения в головном мозге. Аневризма сжимается специальными инструментами, напоминающими клипсы. Кровяной мешочек вовлекается в нормальный кровоток.
- Каротидная эндартерэктомия. Через шею открывается доступ к сонной артерии. Хирург останавливает кровоток и производит разрез в области сужения. Стенки сонной артерии выскабливаются, атеросклеротические бляшки удаляются, разрез зашивается. Операцию лучше проводить под местной анестезией.
- Стентирование сосудов. Это малотравматичное вмешательство, осуществляющееся с целью профилактики рецидива. Через бедренную артерию вводится катетер с расширителем. Инструмент достигает области сужения. Затем устанавливается сетка, расширяющая просвет артерии.
- Селективный тромболизис. Лечение осуществляется строго в первые 6 часов после инсульта. Терапия направлена на растворение тромба внутри сосуда. Лекарство вводится в пораженную область через катетер по артериям (бедренной или сонной).
Многие люди интересуются, какую операцию делают при инсульте. Решение о проведение хирургического вмешательства конкретного вида принимает только нейрохирург. В процессе лечения также участвуют невропатолог и флеболог. На выбор оперативной методики влияют возраст и общее состояние пациента, наличие сопутствующих заболеваний. Важно тщательно просканировать сосуды. По итогам диагностики назначается соответствующий тип хирургического лечения.
Трепанация черепной коробки — длительная и сложная процедура. Нейрохирург проводит у операционного стола от 5 до 15 часов подряд. Восстановление мозгового кровообращения требует внимательности, точности и опыта врача. Открытое хирургическое вмешательство назначается редко, так как существует большой риск опасных для жизни осложнений. Однако в некоторых случаях краниотомия — единственный способ помочь больному человеку.
Открытая операция при инсульте состоит из таких этапов, как:
- Подготовка пациента к проведению трепанации. Анестезиолог вводит больного человека в состояние наркоза. Медикаменты поступают через вену или эндотрахеально. Когда пациент засыпает, его голова фиксируется в специальном устройстве для обеспечения полной неподвижности. Чтобы снизить давление спинномозговой жидкости, в нижней части позвоночника устанавливается люмбальный дренаж.
- Вскрытие черепной коробки. Сначала нейрохирург делает разрез скальпелем по линии роста волос. Кости и череп отделяются от кожи. Сверлом делается отверстие. Медицинской пилой в области будущего хирургического вмешательства удаляется лоскут черепа, который после завершения операции ставится на место.
- Вскрытие мозговой оболочки. Нейрохирург надевает специальные очки с микроскопом. Это позволяет фиксировать малейшие изменения в тканях мозга. Чтобы не повредить здоровые участки, врач оперирует очень тонким инструментом. Твердая мозговая оболочка вскрывается, последствия кровоизлияния удаляются.
- Закрытие полости черепа. Когда основная проблема решена, нейрохирург ставит на место выпиленный лоскут черепа и закрепляет его специальными металлическими скобами. На поверхность кожи накладываются косметические швы. На голове шрама в дальнейшем не видно, так как оперируемая область обрастает волосами.
При ишемическом инсульте, сопровождающемся обширным отеком, может потребоваться декомпрессионная краниотомия. С целью уменьшения сдавливания мозговых тканей удаляется конкретный участок костей черепа. Декомпрессионная операция проводится редко, так как имеет непредвиденные последствия. Удаление черепного лоскута назначается в случае, когда другие методики лечения невозможны или по определенным причинам неэффективны.
Открытое хирургическое вмешательство сопряжено с большим риском для жизни пациента.
Эффективность и безопасность трепанации зависят от оперативности оказания первой помощи, возраста больного человека и тяжести инсульта. Хирургия не всесильна, поэтому в некоторых случаях возникают серьезные осложнения после оперативного лечения. Отмечаются следующие последствия краниотомии:
- эпилепсия;
- внутричерепное кровотечение;
- обширный отек;
- нарушение целостности тканей и сосудов;
- инфицирование;
- частичный или полный паралич;
- проблемы с памятью и речью;
- потеря веса;
- упадок сил;
- неправильное пищеварение;
- временное помутнение рассудка;
- тошнота и рвота;
- головокружения и мигрени;
- трудности с восприятием окружающей действительности.
В некоторых случаях вероятно возникновение повторного инсульта после операции. Рецидив связан со слабостью стенок сосудов и артерий. Во время хирургического вмешательства иногда повреждаются здоровые ткани. В будущем это приводит к повторным кровоизлияниям в мозговую полость. Постоперационный период всегда переносится тяжело. Пациенты практически заново учатся ходить, говорить, писать, читать и т. д. Они постепенно вспоминают факты своей жизни, не сразу узнают родных и близких людей. Однако полное восстановление реально. Главное — это должный уход за больным и усилия самого пациента.
Кровоизлияние в мозг — это тяжелая патология. Она требует длительной реабилитации. Физические и психические ресурсы человека истощаются, поэтому операция проводится своевременно и крайне аккуратно. В некоторых случаях нейрохирург или флеболог не рекомендуют прибегать к хирургическому лечению.
Это связано с вероятностью серьезных осложнений и даже летального исхода.
Существуют такие противопоказания к проведению хирургического вмешательства при инсульте:
- онкологические патологии;
- коматозное состояние;
- повышенное артериальное давление;
- неврологический дефицит;
- сахарный диабет;
- перенесенные менее 6 месяцев назад инсульт или инфаркт;
- гнойное воспаление мозговой оболочки;
- возраст пациента больше 70 лет;
- почечная или печеночная недостаточности;
- сердечная недостаточность.
Если присутствуют одно или несколько из вышеперечисленных противопоказаний, оперативное вмешательство откладывается до нормализации состояния пациента. В редких случаях хирургическое лечение все равно проводится, так как является единственным шансом на спасение. Однако в таком случае выживаемость пациентов составляет лишь 50%. При отсутствии противопоказаний смертность равняется 25%. Эффективность радикальной терапии зависит от индивидуальных физиологических показателей пациента.
источник
Наиболее неприятное и тяжелое осложнение после операции — инсульт.
Американская сердечная ассоциация, основываясь на выявляемых перед операцией показаниях к хирургии, утвердила следующий перечень приемлемой частоты периоперационных инсультов: при лечении асимптомных стенозов периоперационный инсульт должен возникать не чаще, чем в 3% случаев, при наличии ТИА в анамнезе не чаще чем в 5% случаев, при наличии инсульта в анамнезе не чаще, чем в 7% случаев и при лечении рестенозов сонных артерий не чаще, чем в 10% случаев. Если периоперационные инсульты встречаются чаще, чем в указанном перечне, то риск операции превышает возможные ее преимущества.
Инсульт после операции может быть либо ишемическим, либо геморрагическим. Ишемический инсульт после операции, в свою очередь, может быть следствием тромбоэмболии, ишемии пережатия сонных артерий, повреждения артерий или их тромбоза. К факторам риска относятся изъязвленная атероматозная бляшка, предоперационные ТИА или инсульт, окклюзия сонной артерии противоположной стороны, ангиопластика с использованием синтетического протеза и первичное ушивание артерии. Неврологические осложнения обычно возникают в течение 12-24 ч после операции. Этим пациентам требуется либо экстренное дуплексное сканирование, либо реоперация. Если неинвазивные методы с большой степенью вероятности позволяют исключить технические ошибки операции, а также тромбоз сонной артерии, то показано консервативное лечение. Экстренная реоперация показана, когда невозможно выполнить дуплексное сканирование или при его использовании выявлены вышеуказанные осложнения. Повторная ревизия сонных артерий, интраоперационная ангиография или дуплексное сканирование, тромбэктомия и восстановление проходимости сонных артерий позволяют купировать неврологические осложнения.
Геморрагический инсульт после операции относится к редким и необратимым осложнениям. Обычно он возникает в первые 24 ч после операции. К факторам риска его возникновения относятся синдром гиперперфузии, а также назначение антикоагулянтов. В случае возникновения в этот временной промежуток неврологического дефицита показана экстренная компьютерная томография, необходимая для исключения внутричерепного кровотечения. Если КТ неинформативна, то следует выполнить дуплексное сканирование либо ангиографию внутричерепных сосудов. Дальнейшая тактика лечения определяется результатами этих исследований.
- Послеоперационный инсультИнсульты считаются интраоперационными, если после пробуждения от наркоза у пациента появляется новая неврологическая симптоматика, и.
- После операции на сосудахПериод после операции на сосудах в обычных условиях отличается благоприятным течением.
- Артериит сонных артерийАртериит сонной артерии может протекать в виде болезни Такаясу, гранулематозного или гигантоклеточного артериита.
- Осложнения после операции аппендицитаОсложнения после операции аппендицита зависят от степени развития заболевания к моменту диагностики и лечения, общего.
- Инсульт в бассейне сонной артерииПроект исследования инсульта в бассейне сонной артерии показал, что клиническая классификация ишемического инсульта, используемая у.
- Ущемленная грыжа после операцииУщемленная грыжа после операции может сопровождаться явлениями интоксикации, атония кишечника может продолжаться несколько дней, бывают.
15 июля 2016г. сына прооперировали по поводу двухстворчатого аортального клапана. Оперировал Онегов, все прошло прекрасно. После протезировании клапанов сердца механическим протезам необходимо пожизненно принимать антикоагулянт непрямого действия Варфарин до достижения целевых показателей MHO от 2.5 до 3.5. Мы пили одну таблетку в день иногда половику или вовсе пропускали. При этом MHO было за 4. Лечащий врач размышлял вслух «Странно почему так?» Перед самой выпиской нас на выходные отпустили домой (без каких-либо заявлений). Погода в конце июля была очень жаркая, за 30С. Дома минут через 15 сын упал без сознания, (не сел на ноги не сполз по стене, упал как шлагбаум) ударившись затылком о бетонный пол. Я стояла рядом, до меня не сразу дошло, ужас сковал. Не приходил в себя 1-2 минуты для меня как будто час-два. Сил даже плакать не было, какой-то писк выходил из горла. Когда сын пришел в себя началась сильнейшая рвота, онемели руки, нахватало воздуха. Я кинулась звонить леч.врачу, почему-то решила, что это сердце. Рустам Ирекович просил не вызывать скорую, везти самим. С МОЕЙ СТОРОНЫ ЭТО БЫЛА САМАЯ БОЛЬШАЯ ОШИБКА! Каждый день виню себя, что не вызвала скорую. Приехали в отделение, нас встретили, поставили капельницы. Лечащий врач потом как бы между делом сказал, что сын получил, тяжелейшее сотрясение мозга, рекомендовали лежать. На вопрос почему все-таки упал, он мне отвечал одно: жара наверно был скачок сахара в крови. Ни слова про инсульт!! (Только позже в выписке я прочитала результат КТ: инфаркт мозга геморрагический инсульт. И МНЕ НИЧЕГО НЕ СКАЗАЛИ. )
Через 6 дней резкое ухудшение состояние, часов с 10 утра стал спать, я думаю наверно жарко, устал, потом появилась рвота, после обеда сказал болит голова. Была пятница я заметалась между ординаторской и палатой. С 12 до 20ч кололи противорвотные препараты, становилось только хуже. Рустам Ирекович сказал, что рабочий день его закончился, оставляет нас по смене. В 5ч. вечера прошу посмотреть соседку по палате за сыном и опять бегу за врачом. Когда он увидел, что ребенок без сознания, я уже перешла на крик «Сделайте что — ни будь!» он (Рамиль) ответил ЖДЕМ ДО ПОНЕДЕЛЬНИКА! ПРЕДСТАВЬТЕ мы лежим в больнице в кардиохирургии, 21 ВЕК!
Сказал, что если что-то сейчас происходит в голове, то лучше не двигать. И только тут до меня дошло что это не сердце! (Позже мне сказал леч. врач «Мы не заметили симптомов, мы же кардиохирурги, а нейрохирурги! Так зачем нас держали в кардиологии??) дальше, оглушение, сопор, брадикардия и только в 9 ч забрали в реанимацию.
Той же ночью бригада нейрохирургов из дет. Республиканской больницы сделали первую операцию по эвакуации гематомы. Днем следующего дня, сообщили из реанимации: Состояние непредсказуемое, крайне тяжелое, отек мозга. Я пошла к Онегову настаивать на переводе в нейрохирургию, ближе к ночи в состояние искусственной комы (11 дней были в иск.коме ) нас всё-таки перевели в РКБ. Там еще 2 трепанации черепа.
Не передать на бумаге чувства боли и звериного страха за своего ребенка. Видеть сына в луже крови под головой, потому что кровь не останавливалась как оказалось позже (делали анализы в Москве) у нас несовместимость с Варварином. И не выводится он из крови так быстро как у других! НАС СПАСЛИ В РКБ.
В выписке черным по белому написано геморрагический инсульт на фоне приема антикоагулянтов. Врачи загнали нас в тупик, пить Варварин- риск повторного геморрагического инсульта, не пить –ишемический инсульт.
Я хочу спросить у кардиохирургов ВЫСШЕЙ КАТЕГОРИИ этого отделения
-ВЫ, ЧТО НАДЕЛАЛИ.
-ЗА ЧТО ЭТО ВСЕ МОЕМУ РЕБЕНКУ.
-УМЕЕТЕ ЛИ ВЫ ДУМАТЬ В НЕСТАНДАРТНЫХ СИТУАЦИЯХ.
-Почему не предложить перед операцией пройти обследование на совместимость с лекарством которое нужно принимать пожизненно?
Почему довели до таких осложнений.
Почему не перевели в нейрохирургию сразу после падения, чего ВЫ ждали неделю?
источник